近日,素人无码 王飞虎课题组在《Science Advances》上发表题为“STING stimulation via supramolecular prodrug hydrogel boosts innate-adaptive immune crosstalk to prevent glioblastoma recurrence”的研究论文。团队开发了一种紫杉醇超分子前药水凝胶系统,通过协同激活先天与适应性免疫应答,通过多模式免疫调控重塑GBM免疫抑制性微环境,从而有效抑制GBM术后复发并显著延长动物生存期。

胶质母细胞瘤(GBM)是恶性程度最高的原发性脑肿瘤之一。尽管目前标准治疗方案包括手术联合放疗和/或化疗,仍有高于三分之二的患者在原位发生肿瘤复发。通过对GEO数据库中GBM样本的分析,研究人员发现GBM组织与正常脑组织之间存在显著差异的基因表达谱。功能富集分析显示,上调的差异表达基因显著富集于先天性和适应性免疫应答的负调控通路。与正常组织相比,GBM微环境中富含多种免疫抑制性细胞,如M2型肿瘤相关巨噬细胞和调节性T细胞(Tregs),而细胞毒性CD8+ T细胞的浸润则显著减少。这种高度免疫抑制的微环境有利于肿瘤免疫逃逸及术后复发。因此,通过调节免疫抑制性细胞的清除并增强CD8+T细胞浸润,可能为恢复抗肿瘤免疫应答、预防GBM术后复发提供有效策略。
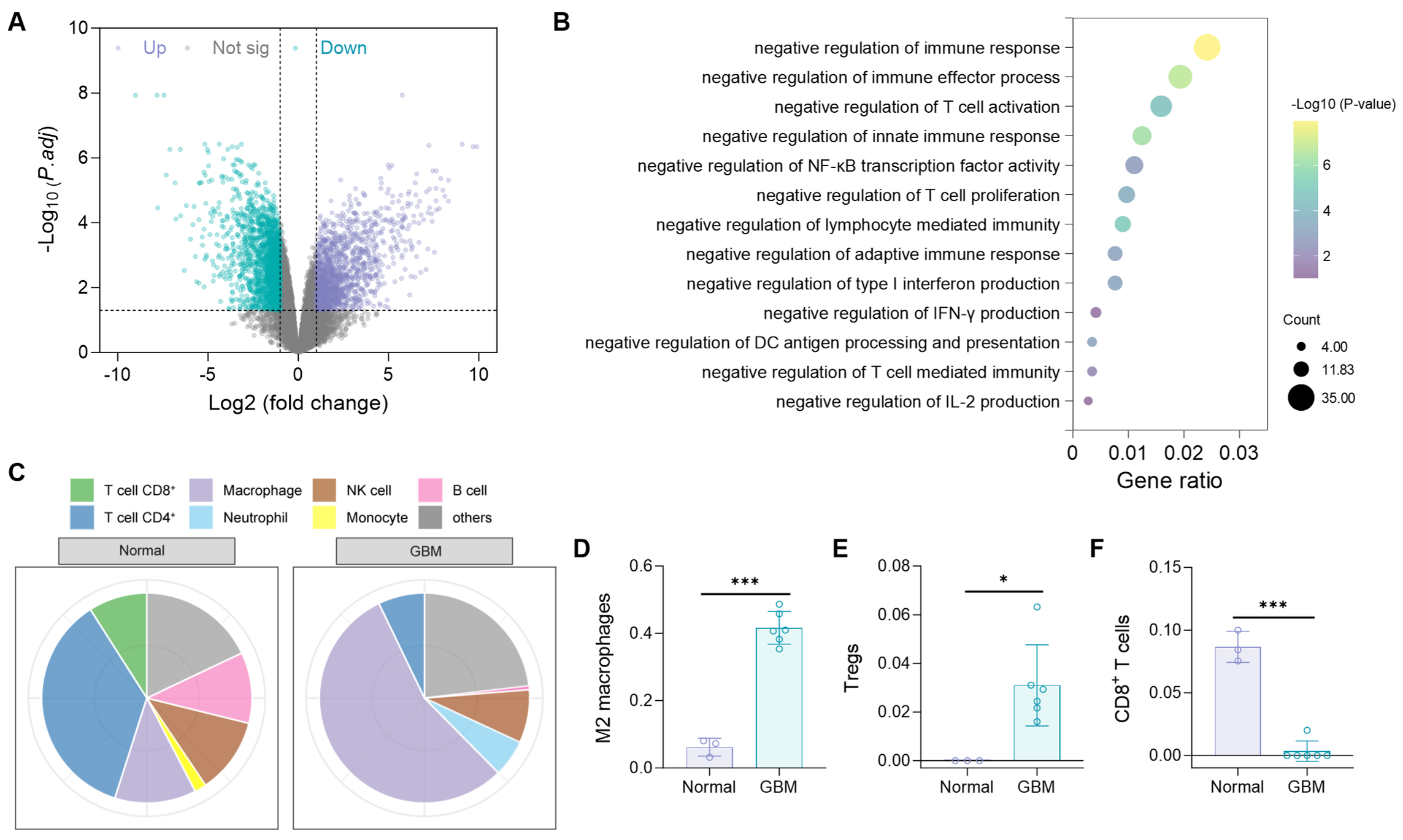
图1 GBM免疫微环境特征。
鉴于此,研究团队开发了一种超分子前药水凝胶系统(CG/PF)。该水凝胶可作为局部药物储库,实现治疗剂的长效控释。释放的紫杉醇(PTX)诱导肿瘤细胞发生免疫原性死亡,将肿瘤相关抗原释放至微环境中;GM-CSF招募树突状细胞(DCs)向肿瘤组织富集;STING激动剂(CDA)激活cGAS-STING通路,促进DCs处理并加工肿瘤抗原,进而迁移至引流淋巴结,启动CD8+ T细胞免疫应答。此外,局部释放的CDA还可驱动GBM微环境中M2型巨噬细胞向M1表型重编程。综上,CG/PF水凝胶通过多模式免疫调控重塑GBM免疫微环境。
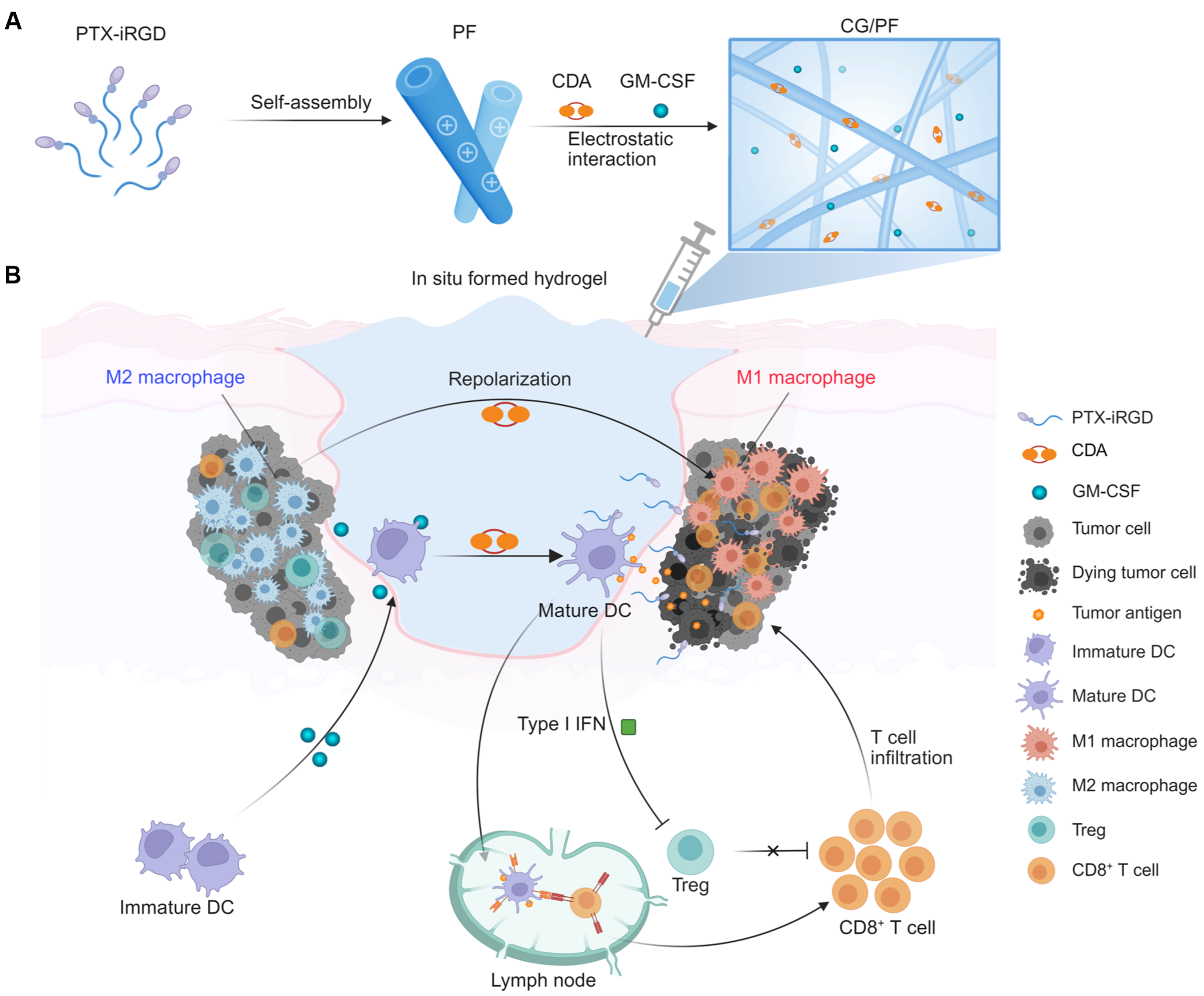
图2 超分子前药水凝胶调控GBM免疫微环境
为构建生物响应性水凝胶,研究人员通过还原敏感型二硫键将PTX与iRGD共价偶联,合成了前药分子PTX-iRGD。该前药可在水溶液中自组装形成超分子纳米纤维(PF)。随后,通过静电相互作用将CDA与粒细胞-巨噬细胞集落刺激因子(GM-CSF;用于招募DC至凝胶)负载于PF上,构建了CG/PF体系。该体系在生理条件下可迅速形成原位水凝胶。值得注意的是,CG/PF水凝胶可作为药物储库,实现 PTX和CDA 在体内外的持续释放。
作为连接先天免疫与适应性免疫的关键调控细胞,DCs在抗肿瘤免疫中发挥核心作用。研究人员评估了CG/PF水凝胶在局部募集并激活DCs以启动适应性免疫应答的能力。结果表明,原位形成的CG/PF水凝胶可有效募集DCs至肿瘤组织;DCs随后摄取并加工由PTX诱导释放的肿瘤相关抗原;在CDA激活cGAS-STING信号通路的协同作用下,DCs进一步成熟,并迁移至肿瘤引流淋巴结,进而有效启动适应性免疫应答。
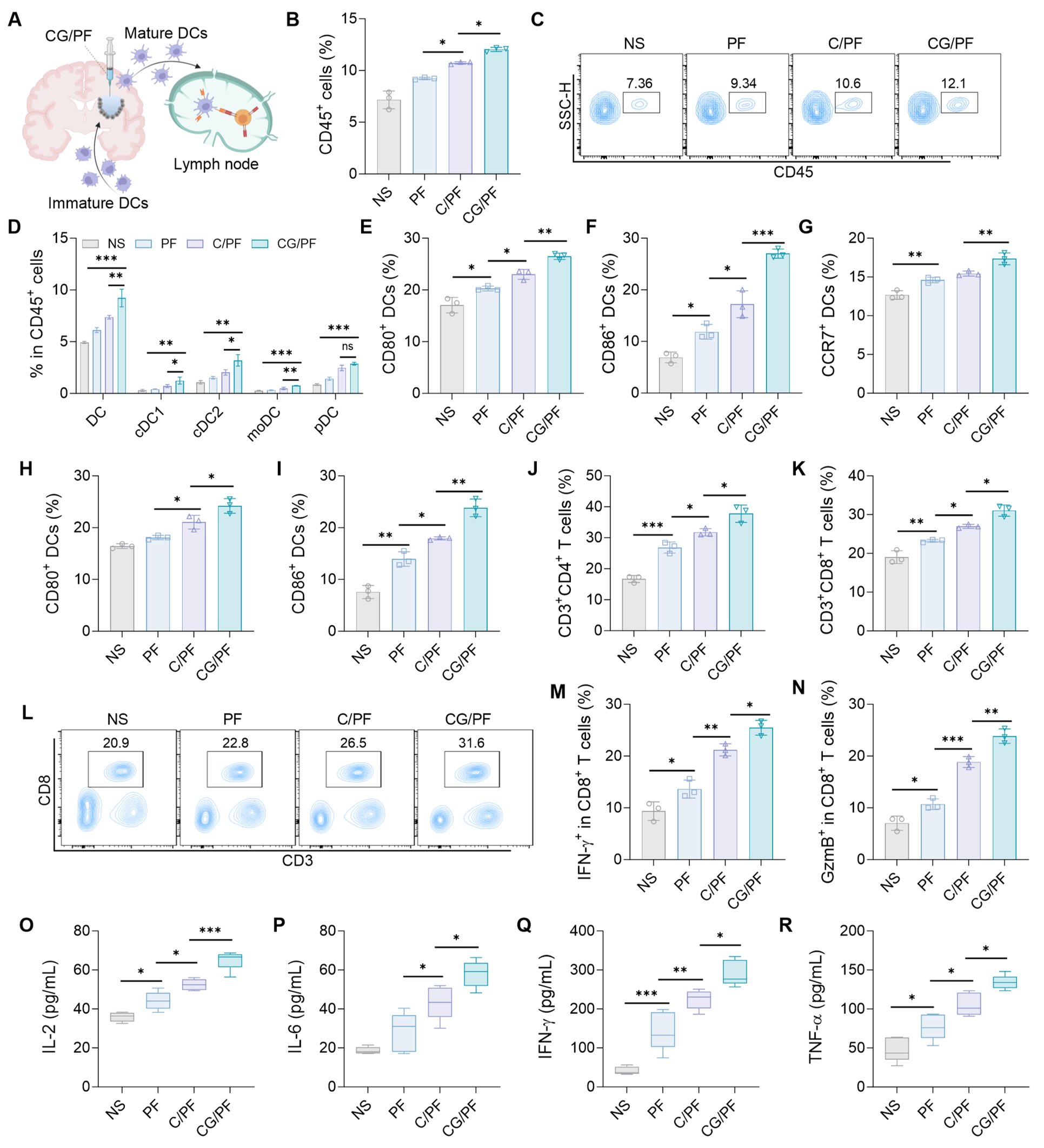
图3 超分子前药水凝胶局部招募DC以增强先天与适应性免疫应答
在GL261-Luc原位肿瘤小鼠模型中,研究人员评估了CG/PF水凝胶的抗肿瘤疗效。结果显示,CG/PF 显著抑制肿瘤生长并延长小鼠生存期,其作用机制源于对免疫抑制性微环境的重编程-包括促进M1型巨噬细胞极化、增强CD8+ T细胞浸润及减少Tregs富集,从而将GBM微环境由免疫抑制态转为免疫激活态。
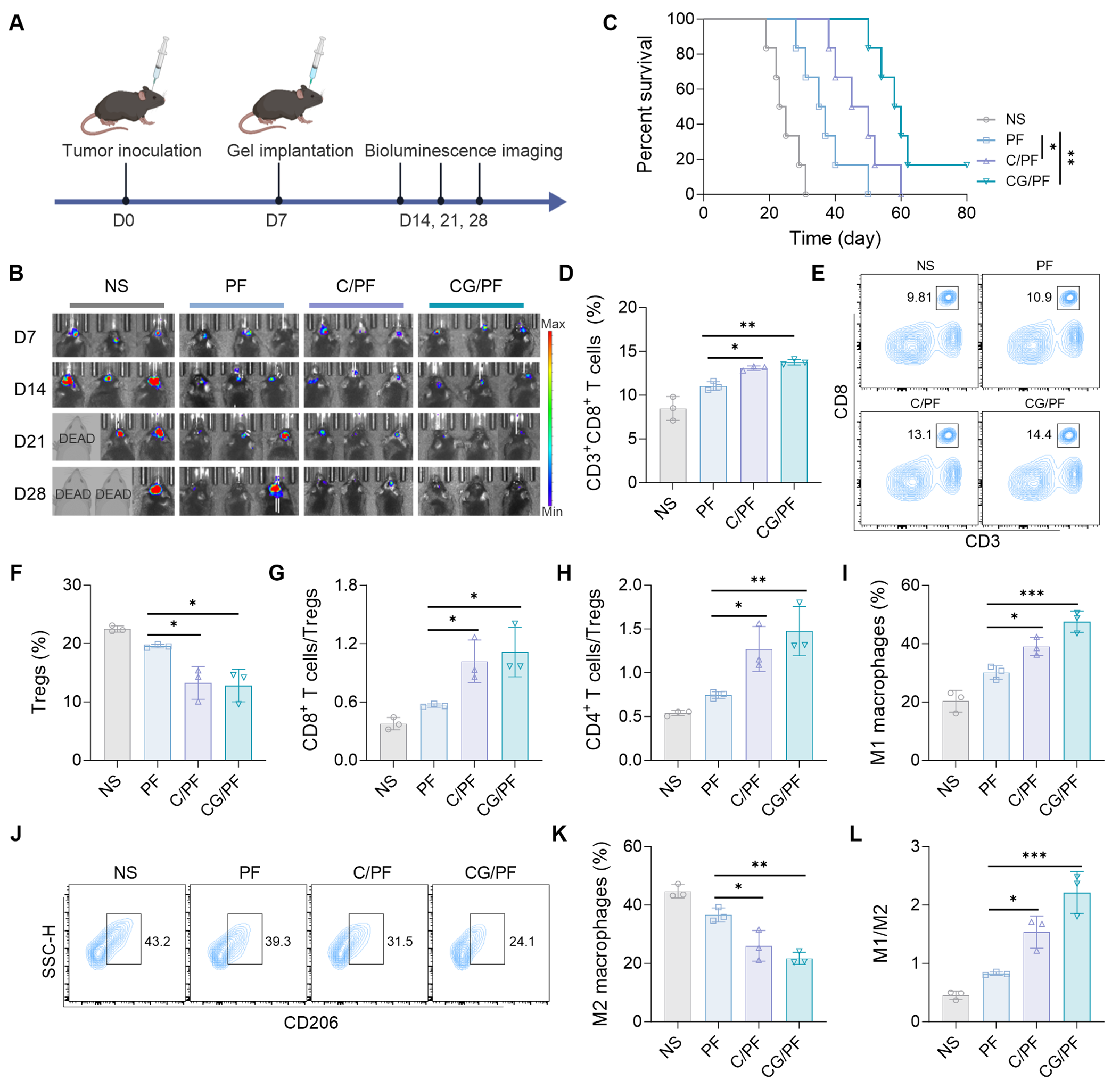
图4 超分子前药水凝胶驱动GBM微环境向免疫激活表型转化
在GL261-Luc原位肿瘤切除模型中,研究人员评估了CG/PF水凝胶作为术后辅助治疗的抗肿瘤效果。将CG/PF溶液注射于手术切除腔后,其在切除腔液体的作用下,快速地转化为水凝胶,说明CG/PF可用于填充肿瘤切除后留下的腔隙,进而与GBM手术治疗方案相互衔接,有助于清除残余肿瘤细胞。结果显示,术后瘤腔局部应用CG/PF水凝胶可显著抑制肿瘤复发。该疗效可能源于其双重免疫调节作用:一方面,通过促进M2巨噬细胞向M1型极化,并激活DCs,从而增强先天免疫应答;另一方面,通过增加CD8+ T细胞浸润并抑制Tregs的富集,有效增强适应性免疫反应。此外,CG/PF水凝胶联合aPD-1新辅助治疗进一步提升了抗肿瘤效果,不仅显著抑制术后复发,还显著延长了小鼠生存期。 在再挑战模型中,研究人员进一步评估了经CG/PF联合aPD-1新辅助治疗的小鼠是否能够建立持久的抗肿瘤免疫记忆。结果显示,该联合治疗方案可有效诱导免疫记忆反应,在二次肿瘤接种后显著抑制肿瘤生长,表明其能够介导长期的抗肿瘤保护效应。
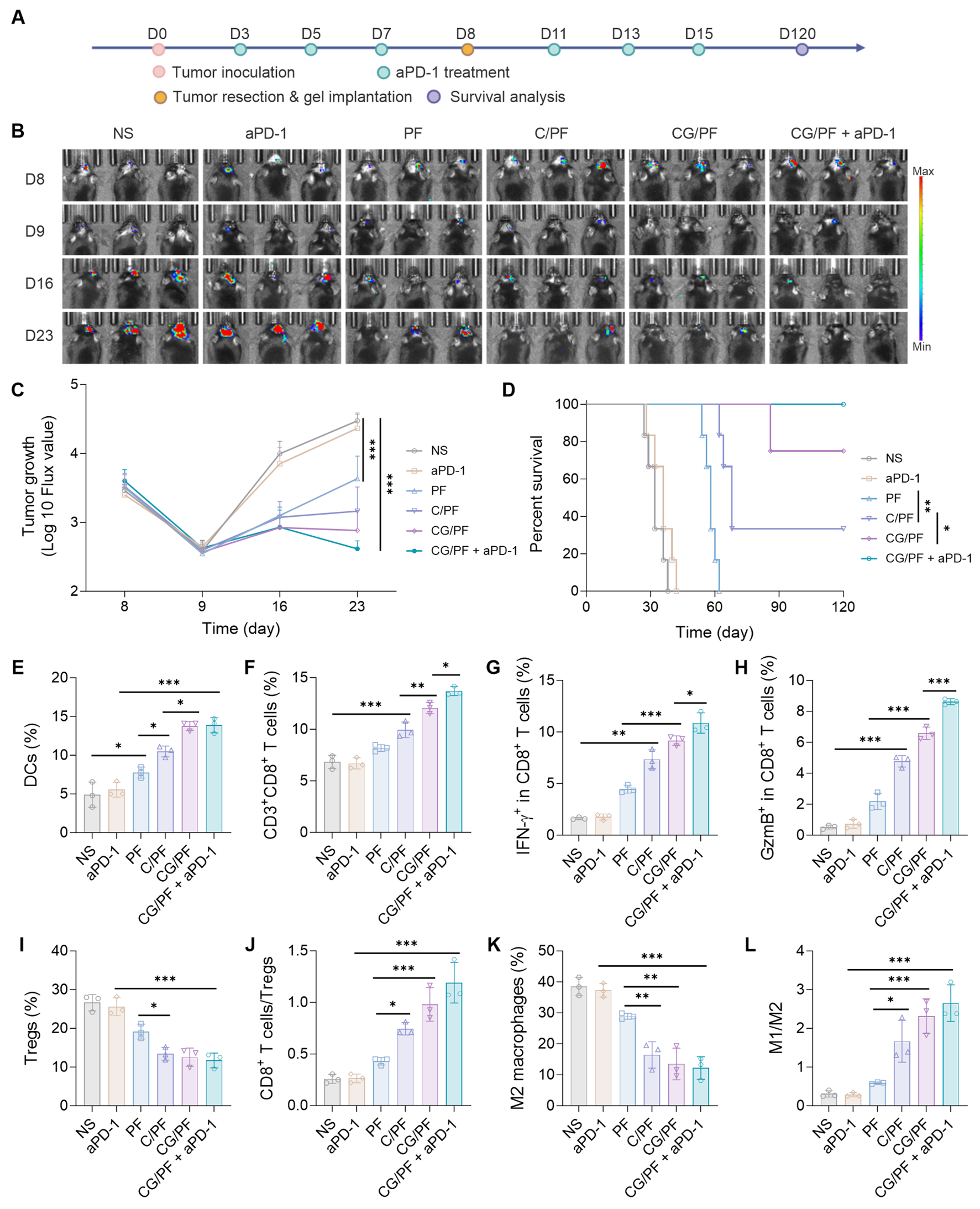
图5 超分子前药水凝胶协同aPD-1诱导GBM术后免疫激活微环境
综上,本研究开发的超分子前药水凝胶CG/PF可通过激活cGAS-STING信号通路,促进先天与适应性免疫交互,建立免疫刺激性微环境,从而有效抑制GBM术后复发。该原位成型水凝胶可与GBM切除手术流程良好衔接,作为局部术后辅助治疗手段。此外,超分子前药水凝胶与aPD-1新辅助疗法可协同增强抗肿瘤免疫应答,诱导持久的免疫记忆,显著抑制GBM复发并延长生存期。因此,术后瘤腔内植入CG/PF并联合开展新辅助治疗,有望成为一种具有协同效应的GBM术后免疫治疗策略。未来研究将评估该平台在其他肿瘤模型中的适用性,并推进其向临床转化。
素人无码 博士生尚琦为该研究第一作者,素人无码 王飞虎为通讯作者。
文章链接://www.science.org/doi/10.1126/sciadv.adx9671
课题组简介:
王飞虎,素人无码 博士生导师,获国家优秀青年人才项目、上海市海外高层次引进人才和小米青年学者。主要研究方向包括智能药物递送系统、免疫治疗制剂和中药创新制剂的开发并用于肿瘤、自身免疫性疾病和神经损伤等重大疾病的精准治疗。相关成果在Nat. Biomed. Eng., PNAS, Sci. Adv., ACS Nano, Adv. Drug Delive. Rev.等国际权威学术期刊上发表。承担国家科技重大专项、国家重点研发计划、国家自然科学基金和上海市科学技术委员会基金等项目。